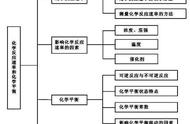
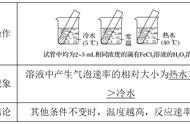
, 计算化学反应速率。
(2)关系式法
利用化学反应速率之比=物质的量浓度变化量之比=化学计量数之比。
(3)“三段式”法
①求解化学反应速率计算题的一般步骤:
a.写出有关反应的化学方程式。
b.找出各物质的起始量、转化量、某时刻量。
c.根据已知条件列方程计算。
②计算中注意以下量的关系:
a.对反应物:c(起始)-c(转化)=c(某时刻)
b.对生成物:c(起始) c(转化)=c(某时刻)
c.转化率=

【例题】将4 mol A气体和2 mol B气体在2 L的容器中混合,并在一定条件下发生如下反应:
2A(g) B(g)

A.用物质A表示反应的平均速率为0.3 mol·L-1·s-1
B.用物质B表示反应的平均速率为0.6 mol·L-1·s-1
C.2 s时物质A的转化率为30%
D.2 s时物质B的浓度为0.7 mol·L-1
【解析】解题时先利用所给条件列出“三段式”:
2A(g) B(g)

起始浓度/(mol·L-1) 2 1 0
2 s内变化浓度/(mol·L-1) 0.6 0.3 0.6
2 s时浓度/(mol·L-1) 1.4 0.7 0.6
依据化学反应速率的定义可知
v(A)=