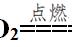我们首先来看铝与酸、碱反应实验对比,
操作,分别在试管中加入稀盐酸和NaOH溶液,放入一小片铝片,观察现象。一段时间后将燃着的木条分别靠近两试管口,用手触碰试管外壁。其操作示意图如图所示,区别不大,就是试管中的溶液有所变化。
对于现象的完整描述如下,可以分成四条来记忆,避免造成记忆混乱:1、试管中产生气泡,2、铝片逐渐溶解,3、点燃的木条靠近试管口时发出爆鸣声,4、试管壁发热。其实一条一条地看的话,现象的描述和操作是一一对应的。

铝与盐酸、氢氧化钠溶液的反应方程式分别如下,这需要各位同学牢记。
这里插播一条学习方法小提示,牢记和死记、硬记是有区别的,牢记是要达到不需要去特别记忆就知道怎么写的这样一个境界,听起来很玄乎,其实操作起来很简单,只需要理解反应为什么会发生,理所当然地就知道反应能够生成什么了,自然而然的写出反应方程式,然后配平,需要的话标气体沉淀等符号,齐活。
好吧,知道给你们讲这些你们也不爱听,还有一个超简单的记忆技巧偷偷告诉你们,就四个字,抄同桌的,当然这招除了考试的时候不好使以外,其他时候都没毛病。
接着往下看,结论,(1)反应刚开始的时候,反应较慢,之后逐渐变快。这是由于以下两个因素共同导致:第一个原因,反应开始时铝片表面的氧化膜阻碍铝片与酸碱反应,随着反应进行,氧化膜溶解,反应速度加快;第二个原因,随反应进行,体系温度升高,反应速度也会加快。两个因素共同促使反应越来越快。

(2)观察反应方程式可知:等量的铝与过量的HCl或NaOH反应时生成H2的量相等。到了视频的第三部分,我们还会从电子转移的角度再次解释这个问题。

相信大多数同学第一次见到铝与氢氧化钠溶液的反应的时候,估计内心都会浮现出这样的弹幕:这反应不讲武德啊,mlgb。对,没聊够吧,那咱接着聊聊这个反应。
2、铝与NaOH溶液反应的实质
铝并非直接和NaOH反应,而是首先与溶液中的水反应生成Al(OH)3,而后Al(OH)3又继续与NaOH生成偏铝酸钠NaAlO2。本质上铝与NaOH溶液的反应分为两步。
第一步,即铝与水的反应,化学方程式可以表示为铝与水反应生成氢氧化铝沉淀和氢气,并配平标出沉淀和气体符号。将该反应标记为反应①。
第二步为所生成的氢氧化铝沉淀与氢氧化钠反应生成偏铝酸钠,方程式如下,将其标记为②。有没有看出一点门道呢,其实在这个反应中,NaOH只起到了使第一步中生成的Al(OH)3溶解的作用,下节课呢我们还会单独把这个反应拎出来讲。