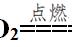先来看计算的原理:物质是由原子、分子、离子等粒子构成,物质之间的化学反应也是这些粒子按照一定的数目关系进行的。
而化学方程式中的化学计量数可以明确的表示出化学反应中粒子之间的数量关系。

来看例子,例如对于氮气和氢气在高温高压下生成氨气的反应中,化学计量数比为1:3:2,因此,参与反应的各物质/物质的量、气体体积和分子数之比都为1:3:2。也就是说1 mol氮气与3 mol氢气生成2 mol氨气,或者说1 体积氮气与3体积氢气生成2体积氨气。又或者说每1个氮气分子与3个氢气分子反应,生成2个氨气分子。
但是质量之比并非1:3:2,而是相对分子质量×化学计量数之比,等于28:6:34。

了解了原理,我们来看一般解题步骤。
第一步,写,写出化学方程式。在做化学计算的时候,写化学方程式这一步至关重要,是解答一道题的基础,方程式写不出来的话这道题是万万没有解决途径的,并且我们在写方程式的时候不仅要写出正确的反应物和生成物,还要对方程式进行配平。所以我们拿到一道题,第一步一定是先写出化学反应方程式,况且退一步来讲,在所有考试中,只要计算题中写对方程式,就能得一步的分。既然咱们已经输在家庭背景上的起跑线上了,就别让化学方程式再拖咱们的后腿。
第二步,标,顾名思义,就是标出计算所需的相关量。
接下来,设,设未知数,这一步在解题的时候根据情况判断是否需要写出来,当使用常用符号来表示的时候,例如用n表示物质的量,V表示体积,m表示质量的时候,设的这一步可以省略不写。
再接下来,列,列出比例式,考试的时候这一步通常还是需要写出来的。不过在本视频中,为了提高各位同学便便的质量,使画面看起来不至于丑到让人便秘,在后面的例题中这一步就省略不写了,你们考试的时候该写还是要写,毕竟考试不是拉便便。
第五步,解,像解大便一样解出待求量。
最后,答,简要的写出答案。
以上为一般解题步骤,这里不再单独给出例题了,可以参考教材上的任意一道例题体会这几个步骤。另外,如果老师讲到现在你还能继续忍受/没摔手机的话,马上你就会看到其实你并不想听的例题了,当这些例题恶心到你的时候,你也可以对照解题步骤来减轻学习例题的不适感。

我们接着讨论过量问题的计算。
若反应中给出了两种或多种反应物的量,应该首先判断这两种反应物是否恰好完全反应,若不能恰好完全反应,则应该继续判断哪种物质能够消耗完全,哪种物质过量。
而我们在计算的时候,应该根据完全消耗的物质进行计算。
也就是说在我们遇到任何计算问题时,都应该首先通过化学方程式确定哪种物质过量。
遇到具体题目的时候,还要注意题目中可能出现的“陷阱”,例如最常见却很容易忽略的就是在有些题目中,反应物中过量的物质与反应的生成物仍能够继续发生反应。
接下来我们就通过一道例题来看看出题人是如何设置这类“陷阱”的。