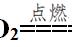这两步反应在溶液中是同时发生的,是以一种你中有我、我中有你的这种未成年人请在父母陪同下观看的状态而存在的,所以一般在写这个反应方程式的时候呢把这两步反应写在一个方程式中,即把这两步反应相加,可以得到如下方程式。
跟我们刚刚学到的方程式略有区别,区别就在于把反应中消耗的水和生成的水都表示了出来。以至于方程式看起来很罗嗦。所以我们课本上并没有给出这个方程式。
那么这个方程式有什么意义呢?当然有意义,只有把反应中的水全部表示出来,我们才能标出反应中的电子转移。
来看反应中的电子转移,铝失去六个电子生成偏铝酸钠中 3价的铝。那氢气中的H是由谁提供的呢?氢氧化钠么?开什么玩笑,刚才白讲了啊,氢氧化钠只起到了溶解氢氧化铝的作用,氢气是水中的氢离子得电子生成的。
也就是水中的氢离子得六个电子,生成氢气。
再来仔细研究一下反应方程式,右边的4个水是哪来的?是左边的六个水中的氢氧根离子先与Al反应生成Al(OH)3沉淀,紧接着Al(OH)3又跟NaOH反应所生成的。
学习到这里有没有一种豁然开朗的感觉呢?没有啊,看来是上帝在你面前遮住了帘忘了掀开啊。想掀开也容易,把视频倒过去再把这两步反应理解了帘子就掀开了。
接下来就进入到垃圾时间了,
所以反应中的还原剂为Al,而氧化剂是水,千万不要搞错。

最后再友情提示一下,书写铝与NaOH溶液反应电子转移时必须写出方程式中省略的4个H2O。下面的这种写法是不能写出电子转移式的。

最后来看无聊的易错点提醒。为什么说无聊呢,因为学会的,不提醒也不会错。学废的,提醒了照样错。不过为了避免收到更多“没聊够吧”这样的留言,这里还是简单给大家提个醒吧。
①Al与NaOH的反应中,还原剂为Al,氧化剂为H2O,NaOH既不是氧化剂也不是还原剂。
②常温下,Al在浓硝酸、浓硫酸中会钝化,不发生反应。
③Al与浓、稀硝酸反应均不生成氢气;Al与浓硫酸在加热条件下反应也不产生氢气。
④尽管铝制品表面有氧化铝组成的致密保护膜,但是氧化铝与酸、碱均能够反应,因此不宜长时间用铝制品保存酸性或碱性食物。

终于进入更加无聊且容易掉粉的第二部分了,那为啥还讲呢,因为这一部分地位过于重要,是几乎所有化学计算的基础,可以说学好这一部分是应付各类大小考试的基础,简直就是:不学不是中国人啊。