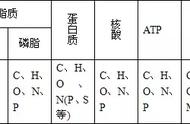
其结构比常规α-螺旋更为松弛,出现在α-螺旋(1653cm^(-1))的蓝区(1658 cm^(-1))。2017年4月,在对蛋白质构象变化有一个大致思路的基础上,给李昊同学布置了一个任务,立即停下他手头在做的与白内障相关的α-晶状体项目,利用新建的设备,开展LHCII脉冲升温时间分辨中红外光谱研究,当时估计实验也就需要三个月的时间,没想到断断续续持续了三年。
继2008年之后,终于又能够应用升级改造后的设备再次回到叶满萍同学中断的地方。因此对于这套数据尤为期待,恰好叶满萍这段时间也在组里做访问学者,无意中见证了激动人心的时刻。李昊对实验数据质量的追求有一种“洁癖”,实验细节把控极严。我在比较了几届学生的LHCII红外光谱后发现,他做的数据质量最高,特别是氘代水溶剂中来自水的吸收干扰,他排除的最好。两片光学窗片夹一层50 μm 厚的含表面活性剂的LHCII液体样品,他在手套箱中装样,做的透明均匀,不含气泡。记得这一貌似简单的装样过程,先前有同学就是无法消除样品池中的气泡,连续做一个多月,哭着来找我,最后我也没有想出好办法,只能靠多装样,凭手气。也正因为这种秉性,看他的数据要催得勤快点。李昊终于告诉我T-jump数据做好了,我在办公室等了半天也没收到邮件,忍不住跑到学生办公室去找李昊。李昊没在办公室,我冲着叶满萍喊了一嗓子 “李昊在哪,他把数据藏着掖着干嘛?!”“他刚才还在,数据在电脑里”,于是叶满萍伸手去碰了一下李昊电脑的鼠标,唤醒了休眠中的屏幕,跳出一幅瞬态光谱图,叶满萍大叫一声:“翁老师,你看李昊的光谱不是和我的一模一样吗!”我压抑住心头的狂喜,冷静地说,你再比较一下你们俩的动力学数据的差异,这回叶满萍服了:李昊的动力学给出了十分平滑的蛋白质去折叠过程的曲线,而满萍的动力学曲线则含有很大的振荡干扰,高下立判。磨刀做设备的功夫终于在这一刻收到了回报。
9 全原子分子动力学模拟——蛋白质动态结构的虚拟实验科研界做实验的往往更相信自己的实验结果,而把理论计算及分子动力学模拟等作为佐证实验结果的锦上添花之作,我也深染这种习气。

结构,而不是相反的过程。实验中分析出新生的α-螺旋有一个微秒尺度的插膜过程,模拟结果得到证实,实验中还发现谷氨酸羧基的红外吸收强度随温度的变化和荧光淬灭曲线几乎一致,推测囊腔侧的谷氨酸有可能是导致荧光淬灭的触发开关,模拟结果证实一个特殊点位的谷氨酸E94,利用氢键起到了开关切换的助力作用。这样实验和模拟结果相互印证的例子还可以举出很多。全原子模拟中有24万多个原子,随着时间在变化,产生海量的数据,如果没有实验上的线索或者理论的预期,这些细节一不知道从何看起,二不知道结构微妙的变化所蕴含的物理意义。
简单地总结一下,全原子分子动力学模拟结果表明,在升温过程中,蛋白质部分结构单元会发生失水作用,导致结构单元间的疏水作用增强,

一段无规卷曲结构协同转变为α-螺旋,并引起α-螺旋E和D向疏水核内部插入运动,从而在原子尺度上阐释了脉冲升温—时间分辨光谱观察到的蛋白质二级结构的变化。新生的α-螺旋E和D插膜运动引起的别构效应驱动一对交叉排列的跨膜螺旋A和B发生剪切运动,导致附着于跨膜螺旋对上的叶绿素分子与相邻的叶黄素分子之间的间距随温度的升高或酸度的增加而变小。进一步通过量子化学计算,揭示叶黄素分子 (LUT) 暗态

也随温度升高而增强,导致叶绿素激发态的荧光淬灭,并且荧光淬灭主要发生在LUT-Chl612这一色素对上。
这次和高加力课题组实验和理论的配合,彻底改变了我对分子动力学模拟的成见,可以说分子动力学模拟已经达到了蛋白质动态结构虚拟实验的水平,当然人的因素永远是第一位的。
10 热、酸触发的LHCII剪叉式升降运动实现高效捕光到能量淬灭的切换我们的研究结果表明,LHCII恰如剪叉式升降机一样的分子开关 (图5) ,在热效应或酸诱导的疏水作用下,触发螺旋E与D向疏水内核的插膜运动,将动力分别传给剪叉的两臂螺旋A与B,引起像剪叉式升降机一样的运动,迫使叶黄素分子和相邻的叶绿素分子相互接近,从而实现叶绿素激发态的能量淬灭。从机械的角度,还能够找到剪叉式升降机所对应的关键部件。类囊体腔侧的螺旋E与D为一对顶杠,螺旋D端的残基L206与螺旋B末端残基V80、L84,螺旋E端的残基W97与螺旋A的末端残基F194、F195分别构成了类囊体腔侧的两个顶杠作用力支点。一对交叉排列的螺旋A和B为升降的两个剪切臂,其交叉点处的盐桥 (Arg70-Glu180,Glu65-Arg185) 为铰点。温度升高或酸度增加时,螺旋E和D分别从跨膜螺旋A与B交叉面的内侧将螺旋剪叉臂顶开,导致剪叉角度增加,带动两个剪叉式排列的叶黄素分子做相应的开叉运动,缩短了叶黄素分子与相邻的叶绿素分子之间的距离,增强了色素之间的电子态耦合作用,提高了叶绿素激发态荧光淬灭的效率。尤其在低温条件下,位于腔侧的谷氨酸 (E94) 与螺旋E近端的赖氨酸K99形成氢键,随着温度的升高,螺旋E逐渐朝中心靠近,E94-K99之间的相互作用减弱,而E94与处于螺旋E 中段的谷酰胺Q103形成新的氢键,这说明E94协同参与了螺旋E的插膜过程。上述模型与已报道的分子生物学中单点突变的实验结论相符合,如将E94突变成电中性甘氨酸,会导致非光学淬灭效率的降低。可见E94恰如开关中的触臂,K99及Q103分别为两个触点,当E94与K99相触的时候,系统处于高效捕光态,而当E94与Q103相触的时候,则处于光保护状态。