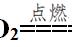我们来看一道利用守恒法解答的例题,含0.2 mol NaOH的烧碱溶液,在标况下吸收CO2气体3.36L,最终体系中只含有Na2CO3和NaHCO3(不考虑水),求两种物质的量各为多少?
有没有觉得这道题很熟悉,废话,一秒钟前刚刚讲过,连数字都没变!这都没印象的话还是趁早买个炉子去路边卖烤红薯吧,算了,可能烤红薯并不适合你,毕竟烤红薯也需要控制煤炭与空气的混合比例调节燃烧速度控制炉内的温度,这样烤的红薯才能外焦里嫩,又香还省煤。看到没,化学学不好红薯都烤不香。
其实仔细阅读这道题,和刚才那道例题还是有一点细微的区别,这道题中直接给出了最终体系中只含有碳酸钠和碳酸氢钠这两种物质,如果题目中没有明确的给出这样的信息,我们还是需要通过计算判断过量问题。具体计算前面刚刚讲过,这里就不再啰嗦了,这么快就忘了的话建议预防一下阿尔茨海默症呢。
这里我们利用守恒法来解题,首先假设生成Na2CO3的量为x mol,NaHCO3为y mol。这里我们设了x和y这两个未知数而没有用n来表示物质的量,所以假设这一步一定要体现出来。
由于产物中的Na全部来自于NaOH,x mol Na2CO3含Na元素2x mol,y mol NaHCO3含Na元素y mol,根据Na守恒,所以有2x y = 0.2 mol。
再根据碳守恒,也就是产物中的C元素全部来源于参与反应的CO2,而CO2的量为3.36/22.4= 0.15 mol。同时x mol Na2CO3含C元素x mol,y mol NaHCO3含C元素 y mol,所以x y =0.15 mol。
解一下这个小学水平的一元二次方程,即可得到Na2CO3的量为0.05 mol,NaHCO3为0.1mol。怎么样,刚才讲了半天的解题方法是不是瞬间就不香了呢,利用守恒法解题是不是成了新的小甜甜呢?

估计拖堂是所有老师的通病吧,我视频的时间也变得越来越长了,没想到自己也变成自己曾经最讨厌的样子了。反正既然如此了,咱们索性把体育课的时间也占了吧,再来讲最后一个专题,Al与NaOH、HCl溶液反应的计算,好在这部分没什么技术含量,就当带着大家做准备运动了吧。

1、Al与HCl、NaOH溶液放出H2情况的讨论
方程式,我们已经讲过很多次了,不再重复,放在这里,方便后面内容的讲解。
我们来分情况讨论,反应中放出的H2都是溶液中的H 还原而来,而H 还原所得到的电子均来自参与反应的Al,因此不论是与酸或碱反应,都遵循2Al~3H2这一关系式(得失电子守恒)。
所以当Al的量相同且均完全反应时(即Al为少量时),不论与酸或碱溶液反应生成的H2的量均相同;即V(HCl) : V(NaOH) = 1 : 1 。

当Al过量时,根据方程式可以分别得出如下关系式:
6HCl~3H2,即2HCl~H2;
2NaOH~3H2 ,即2/3NaOH~H2
所以若生成相同体积H2时,所需n(HCl): n(NaOH) = 2: (2/3) = 3 : 1。
也可以说是,等物质的量的HCl和NaOH与过量的Al生成的氢气体积比为V(HCl) : V(NaOH) = 1 : 3。