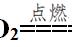观察反应可以知道,
增加的固体质量是生成的四氧化三铁与反应消耗的铁单质的质量差。所以,我们可以利用差量法来解。
这道题中用到了质量差,所以你应该还不犹豫的在方程式的旁边写一个大大的Δm。
就像这样。Δm表示的就是反应前后固体物质的质量差。
题目中要、求参加反应的铁粉的物质的量,所以我们列比例式时,
就在Fe下面写上3 mol,那么此时Δm即为生成四氧化三铁的质量减去反应的铁单质的质量,
等于64 g。也就是每3 mol铁完全反应生成四氧化三铁,反应前后固体的质量差为64 g。
然后设未知数,列出方程式,并求解。可得铁的物质的量为1.5 mol。
综上,利用差量法解题的关键在于寻求差量与物质之间的比例关系。

(2)关系式法。
当已知物与待求物之间靠多个反应联系时,只需直接确定两者之间的比例关系式即可。
什么意思呢,我们还是来看例题。
例如:用CO还原Fe2O3,将生成的CO2通入澄清石灰水,求沉淀CaCO3的量。
沉淀CaCO3中的碳元素全部来源于CO2,而CO2中的碳元素又全部来源于CO。
因此可以得出结论,每一个CO分子与Fe2O3反应将会生成一个CO2分子,而每个CO2与氢氧化钙反应又会生成一个碳酸钙分子,因此CO与CO2与CaCO3的比例应该为1:1:1,所以可以得出关系式:一个CO对应一个CO2又对应一个CaCO3。而利用这个关系式,跳过了繁琐的中间步骤,直接将最初的反应物CO与最终需求解的生成物CaCO3联系了起来,使解题也变得更加容易。

(3)守恒法,质量守恒,宏观上来看是反应前后元素质量守恒。
微观上来看是反应前后的原子个数守恒。
得失电子守恒,氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等。

电荷守恒,电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数相同,即正负电荷总数相同。
离子反应方程式中,反应物所带电荷与生成物所带电荷总数相等,且电性相同。
以上这些守恒定律都可以在解题的时候灵活应用,增加解题的灵活性。