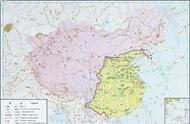
12.科学家尝试通过多种途径减少CO2的排放,或将CO2转化为有用的物质。其中一种途径是利用NaOH溶液来“捕捉”CO2,并将CO2储存或利用,反应流程如图所示。

(1)反应分离室中分离物质的操作是 。
(2)上述反应流程中,可循环利用的物质是 。
(3)若反应分离室中有溶质质量分数为10.6%的Na2CO3溶液100千克,求完全反应后,理论上可生成CaCO3的质量(要求根据化学方程式计算)。
13.石灰石是我省的主要矿产之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下表:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成的CO2质量/g | 1.76 | 3.52 | 4.4 | m |
(1)哪几次反应中碳酸钙有剩余?
(2)上表中m的值为?
(3)试计算这种石灰石中碳酸钙的质量分数。
14.烟酸(化学式为C6H4NO2)是人体必须的13种维生素之一,具有扩张血管的作用。请回答下列问题:
(1)烟酸含有 种元素;
(2)烟酸分子中碳、氢、氮、氧的原子个数比为 。
15.若1个A原子的质量为akg,1个碳12原子(含有6个质子和6个中子的碳原子)的质量为bkg.请计算:
(1)A原子的相对原子质量为 .
(2)1个碳12原子的核外电子数为 .
16.氢气的储存是科学研究热点之一。X是一种储存氢气的材料,取11.2g X在O2中完全燃烧后只生成8.0g CuO、8.0g MgO。
(1)上述燃烧过程中消耗O2的质量为 克。
(2)通过计算求X中各元素的原子个数比。(写出计算过程)
17.丁酸乙酯是无色有菠萝香味的液体,其密度为0.87g/cm3,难溶于水,可与油类互溶。现取11.6g丁酸乙酯在氧气中完全燃烧,只产生26.4gCO2和10.8gH2O。
(1)含有丁酸乙酯的物品应远离火源。若丁酸乙酯燃烧, (填“能”或不能”)用水来灭火。
(2)丁酸乙酯可与油类互溶,这种性质属于 性质。
(3)丁酸乙酯中碳元素和氢元素的质量比为 。
18.2013年5月,某市自来水有股奇怪的味道,经专家多轮综合检测,基本认定引起此次异味的主要物质是邻叔丁基苯酚。将30克邻叔丁基苯酚完全燃烧,生成88克CO2和25.2克H2O(无其他产物)。已知邻叔丁基苯酚的相对分子质量为150,求:
(1)30克邻叔丁基苯酚中含碳元素 克,氢元素 克。
(2)邻叔丁基苯酚的化学式为 。
19.我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了杰出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠,现有纯碱样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体全部逸出,得到不饱和氯化钠溶液。反应过程中测得烧杯内溶液的质量(m)与反应时间(t)关系如图所示。试回答:
(1)生成CO2的质量为 g。
(2)22.8g样品中碳酸钠的质量为多少?
(3)计算所得溶液中溶质的质量分数。

20.取20g氢氧化钠溶液于烧杯中,将9.8%的稀硫酸逐滴加入烧杯,边加边搅拌,随着稀硫酸的不断加入,溶液pH的变化如图所示,回答下列问题:(1)a点溶液中的溶质是Na2SO4和 (填化学式)。
(2)计算该氢氧化钠溶液的溶质质量分数(写出计算过程)。

21.近期,央视对“用棉花代替肉松制‘肉松饼’”的消息进行辟谣.资料表明:肉松是用动物肌肉制作的蓬松絮状肉制品,棉花主要含有植物纤维.
(1)棉花属于 (填“天然”或“合成”)有机高分子材料.
(2)肉松中含量最多的营养素是 .
(3)可用燃烧法鉴别肉松与棉花,点燃时闻到烧焦羽毛气味的是 .
(4)制作肉松饼使用的发酵粉中含有碳酸氢铵(NH4HCO3).碳酸氢铵中氢和氧两种元素的质量比为 .
22.人类为了维持生命和健康,必须摄取食物,以获得营养.
(l)六大基本营养素包括 、糖类、油脂、维生素、无机盐和水.
(2)葡萄糖(C6H12O6)由 种元素组成(填数字).
(3)葡萄糖中碳元素的质量分数为 .
23.人体摄入锌不足会引起多种疾病,缺锌者可在医生指导下通过服用葡萄糖酸锌口服液来补锌。已知葡萄糖酸锌的化学式为C12H22O14Zn.填空:
(1)葡萄糖酸锌中属于微量元素的是 ;
(2)葡萄糖酸锌的相对分子质量为 ;
(3)葡萄糖酸锌中锌元素的质量分数为 (计算结果精确到0.1%)。
24.维生素C(化学式为C6H806)对人体皮肤和牙龈的健康有重要作用,缺乏维生素C会引起坏血病.经研究表明,青少年每天都需要摄入60mg的维生素C,若其中的12mg由水果补充.请计算回答:
(1)维生素C中碳、氢、氧三种元素的质量比是 ;
(2)若食用的水果以苹果计,已知每100g苹果中含维生素C的质量为4mg,那么每天需吃苹果的质量是 g.
25.配制500mL的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3)。请计算:
(1)得到氢氧化钠溶液的质量为 g。
(2)需要氢氧化钠的质量为 g。
(3)需要水的质量为 g。
26.蛋白质是由丙氨酸(C3H7NO2)等多种氨基酸构成的。根据丙氨酸的化学式计算:
(1)C3H7NO2的相对分子质量是 。
(2)丙氨酸中各元素的质量比C:H:N:O= 。
(3)丙氨酸中氮元素的质量分数为 (结果保留0.1%)
(4)8.9g C3H7NO2中含有氢元素的质量是 g。
27.过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO2),发生的化学反应为BaO2 H2SO4═BaSO4↓ H2O2,当恰好完全反应时生成23.3g沉淀。计算:
(1)加入BaO2的质量。
(2)反应后所得溶液中溶质质量分数。
(3)医用双氧水常为溶质质量分数为3%的过氧化氢溶液,如果将(2)中所得溶液稀释到医用双氧水浓度,计算需加入水的质量(结果精确到0.1g)。
28.碳酸氢钠是面点膨松剂的主要成分之一。
小芳同学研究反应2NaHCO3 H2SO4═Na2SO4 2H2O 2CO2↑中NaHCO3与CO2之间量的关系。
(1)理论计算:1.26g NaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量(写出计算过程)。
(2)实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后质量变化值 (填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是 。
反应前 | 反应后 | |
NaHCO3/g | 锥形瓶 稀硫酸/g | 锥形瓶 反应后溶液/g |
1.26 | 24.59 | 25.36 |