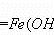在制备Fe(OH)3胶体时,一般要注意以下几点。
制备Fe(OH)3胶体时,不能用FeCl3与NaOH反应,因为会生成Fe(OH)3沉淀而非胶体。方程式如下。
一般用饱和FeCl3溶液来制备Fe(OH)3胶体。并且不能用自来水代替蒸馏水,因为自来水中的离子会使Fe(OH)3胶体聚集成Fe(OH)3沉淀。
为了加速反应,一般要加热煮沸,但是当溶液呈红褐色的时候应停止加热,避免加热破坏Fe(OH)3胶体而生成沉淀。

此外胶体还有一些特殊的性质,
光学性质——丁达尔效应——可以利用丁达尔效应来鉴别溶液和胶体。
运动学性质——布朗运动——这也是胶体能够稳定存在的一个重要。
电学性质——电泳现象——由此可知胶体粒子带电,并可以利用电泳判断胶体粒子所带电荷是正还是负。
热力学性质——胶体的聚沉。

胶体在我们的日常生活中也有许多应用,不然谁还费劲巴拉的学这些啊。
例如农业上讲到的土壤保肥作用;医疗卫生中用到的血液透析,电泳分离氨基酸和蛋白质等;我们日常生活常听到的卤水点豆腐,以及我们常喝的豆浆、牛奶、粥等,都跟胶体息息相关。
另外,例如,明矾净水,不同型号的墨水不能混用,则用到了胶体沉聚的知识。
在自然界中,江河入海口处的三角洲等;以及工业生产中提到的有色玻璃,工业除尘,电泳选矿,原油脱水等,都离不开胶体的相关知识。

下来我们来看关于胶体的一些注意点,首先是胶体与纳米材料,纳米材料和胶体有一个最大的相同点就是粒子的直径都在1-100 nm之间,所以会有一些同学搞混。首先要明确的是纳米材料不一定都是胶体,因为胶体属于分散系,一定有分散质和分散剂,是混合物;而纳米材料可以是纯净物,例如纳米硅、纳米碳等。
胶体和溶液,两者的根本区别是分散质的粒子大小不同,另外,两者都不带电,并且都是混合物。这里说的不带电是指整体不带电,而分散质粒子是可能带电的,就像溶液中的离子是带电的,胶体中的胶体粒子也可以是带电的,但是溶液和胶体整体都是电中性的。
丁达尔效应是胶体特有的光学效应,可以用来鉴别胶体,但并非胶体的本质特征,胶体区别与其它分散系区别的本质特征只有一个,就是胶体粒子直径介于1-100 nm之间。